

我院陈俐娟/杨建洪/陈强/黎勇团队在PNAS发文首次揭示肿瘤治疗靶点Tubulin的新位点
时间:2025-03-183月11日,四川大学华西医院生物治疗全国重点实验室陈俐娟/杨建洪团队,陈强团队及四川大学华西医院护理创新研究中心黎勇团队合作在PNAS杂志发表题为《Identification of a ligand-binding site on tubulin mediating the tubulin–RB3 interaction》的研究论文。该研究凭借前沿的科研技术与深入的探索,在细胞生物学领域取得了关键进展,首次成功揭示了位于微管蛋白(Tubulin)上的一个全新抑制剂结合位点。
这并非该团队在 Tubulin 研究上的首次突破。在此之前,团队已相继发现 Pironetin 位点(发表于《自然通讯》,2016 年)和 Cevipabulin 位点(发表于《科学进展》,2021 年) 。此次 Tumabulin 位点的发现,是他们在该领域研究的又一重大飞跃。
该位点位于Tubulin-RB3-TTL复合物中α1-Tubulin、β1-Tubulin和RB3的界面区域,被命名为Tumabulin位点。Tumabulin类化合物作为“分子胶”,显著增强了RB3与Tubulin二聚体之间的相互作用,从而提升了RB3的微管解聚活性。
Tumabulin位点的独特之处在于其结合完全依赖于RB3的存在,且结合到该位点的小分子不会直接破坏微管的聚合,而是通过增强RB3与Tubulin的相互作用,显著提升RB3固有的微管解聚活性。这一发现揭示了一种全新的Tubulin抑制机制,为针对RB3高表达癌症的选择性抗癌药物设计开辟了新途径,对Tubulin靶向药物的开发具有重要科学意义。

αβ-Tubulin异二聚体是微管的核心组成单元,而微管在癌细胞的有丝分裂中扮演着至关重要的角色,因此成为癌症化疗的重要靶点。以紫杉醇和长春碱类药物为代表的Tubulin抑制剂,在临床上已展现出显著的抗有丝分裂活性。根据作用机制的不同,Tubulin抑制剂可分为三大类:微管去稳定剂(Microtubule Destabilizing Agents, MDAs)、微管稳定剂(Microtubule Stabilizing Agents, MSAs)以及近年来发现的微管靶向降解剂(Microtubule-Targeting Degraders, MTDs)。结构生物学研究已成功解析了Tubulin二聚体上的八个主要结合位点(图1),其中涵盖了紫杉醇、秋水仙碱、长春碱、laulimalide、美登素、Pironetin、Cevipabulin和Todalam结合位点。其中,MSAs通常结合于紫杉醇和laulimalide位点,通过稳定微管结构抑制其解聚;而MDAs则主要靶向秋水仙碱、长春碱、美登素、Pironetin、Cevipabulin和Todalam位点,通过干扰微管聚合或促进其解聚发挥作用。MTDs则主要作用于Cevipabulin位点,同时也包括部分靶向秋水仙碱位点的降解剂,通过诱导Tubulin降解实现抗肿瘤效果。这些结合位点的发现为Tubulin抑制剂的开发提供了重要的结构基础,同时也为针对不同机制的抗癌药物设计开辟了新的方向。
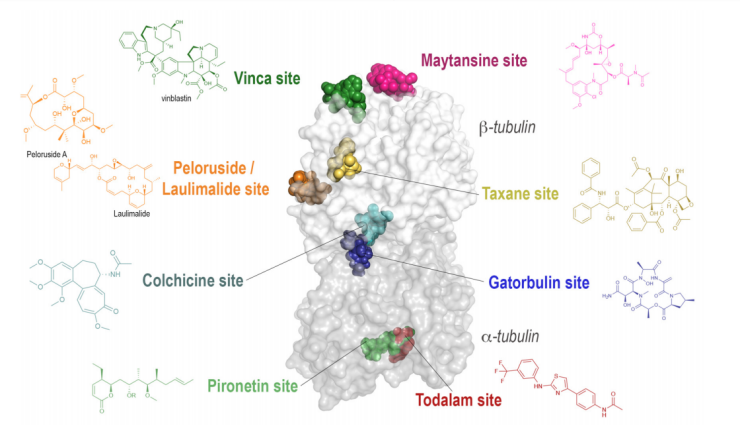
Tubulin二聚体上已报道的8个抑制剂结合位点
本研究通过解析Tumabulin类化合物Tumabulin-1(TM1)与Tubulin复合物的晶体结构,揭示了其独特的结合模式。研究中使用了广泛应用的Tubulin-RB3-Tubulin酪氨酸连接酶(TTL)复合物晶体。通过分析TM1结合的Tubulin-RB3-TTL复合物的晶体结构,研究人员观察到TM1不仅与已知的秋水仙碱位点结合,还同时结合到一个先前未被识别的位点,科研团队将这一新发现的位点命名为Tumabulin位点。该位点处于Tubulin-RB3-TTL复合物中α1-Tubulin、β1-Tubulin和RB3三者界面的交界区域。值得注意的是,两个TM1分子在该位点内以堆叠的方式结合,完全填充了结合口袋,并形成了强烈的分子间相互作用。
然而,由于TM1同时与秋水仙碱位点和Tumabulin位点结合,这两个位点之间的潜在干扰可能影响对TM1在Tumabulin位点的特定生化功能的准确解析。为克服这一限制,科研团队精心设计并合成了化合物TM2。TM2对Tubulin-RB3复合物的Tumabulin位点具有高度选择性,且不与秋水仙碱位点发生相互作用。
功能实验表明,TM2显著增强了RB3与Tubulin的结合。进一步研究发现,TM2本身对Tubulin无直接解聚作用,但显著增强了RB3对Tubulin聚合的抑制作用,提示TM2通过结合Tumabulin位点增强了RB3的Tubulin解聚活性。
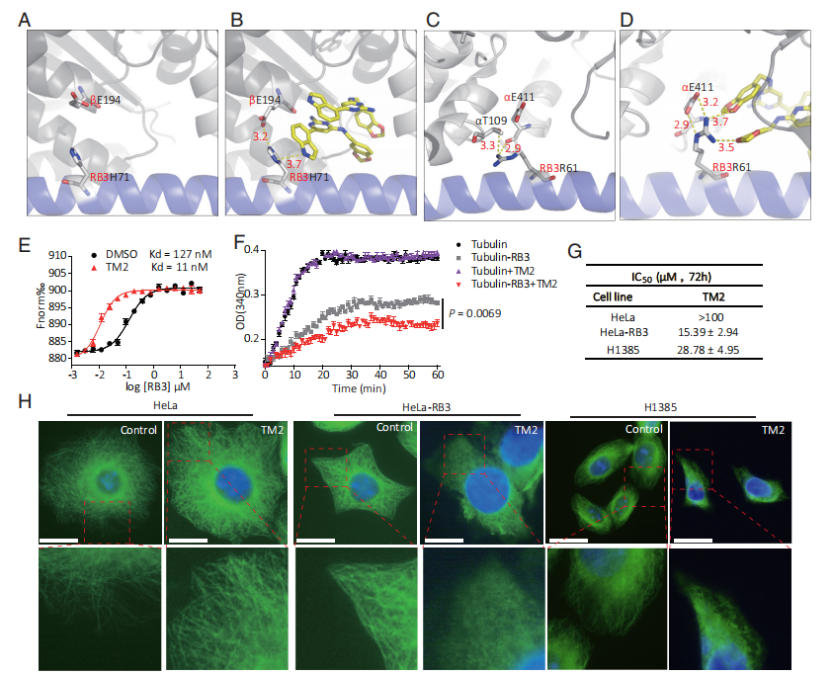
TM2抑制微管的作用机制
该研究成功确定了Tubulin上一个新的配体结合位点,该位点在介导Tubulin与RB3之间的相互作用中表现出独特的功能,为下一代抗癌Tubulin抑制剂的发现和研究奠定了重要基础。
华西医院杨建洪副研究员、陈强研究员及黎勇副研究员为该论文的共同通讯作者。黎勇副研究员、张楚枫博士后、唐冬梅博士后、王涛助理研究员及闫伟助理研究员为共同第一作者。四川大学华西医院为该成果唯一完成单位。